可视化分子的三维结构
这个例子展示了如何显示、检查和注释分子的三维结构。这个例子实现了两个相关蛋白质结构的三维叠加。
介绍
泛素是一种含有约76个氨基酸的小蛋白质,存在于所有真核细胞中,并在物种中保存得很好。泛素通过对多种蛋白质的翻译后修饰,参与多种多样的生物学过程,包括蛋白质降解、蛋白质运输、DNA修复、基因调控等。由于泛素在细胞中广泛存在,并参与许多基本过程,因此泛素在序列、结构和功能等方面都受到广泛的研究。
从PDB数据库下载晶体结构文件,然后使用molviewer函数。默认情况下,蛋白质结构是这样的:每个原子用一个球表示,每个键用一个棒子表示。您可以通过选择图下面的显示选项来更改呈现模式。还可以通过单击-拖动蛋白质或在脚本控制中输入Rasmol命令来旋转和操作结构。
在本例中,我们将通过传递给的Rasmol命令的组合来探索泛素的结构特征evalrasmolscript函数。但是,您可以使用Molecule Viewer窗口执行相同的分析。泛素蛋白的信息在mat文件中ubilikedata.mat.
负载(“ubilikedata.mat”,“无论在哪里”)
或者,您可以使用getpdb函数从PDB库中检索蛋白质信息,并将其加载到MATLAB®中。请注意,公共存储库中的数据经常被管理和更新;因此,当您使用最新的数据集时,此示例的结果可能略有不同。
无论在哪里= getpdb (“1ubi”);
h1=molviewer(ubi);
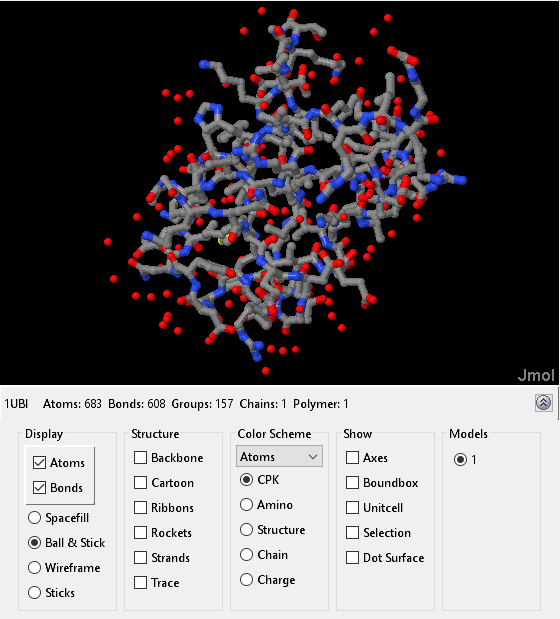
evalrasmolscript (h1,"全选,;线框100;背景黑);
呈现分子
我们可以使用“卡通”渲染来查看泛素折叠,它清楚地显示了二级结构元素。我们将选择范围限制在蛋白质上,因为我们对显示其他异质性粒子(如水分子)不感兴趣。
%将分子显示为卡通,并根据其颜色对原子进行着色%二级结构分配。然后移除其他原子和键。evalrasmolscript(h1[“spacefill;线框;”...“限制蛋白质;卡通;颜色结构;“...'选定中心;']);
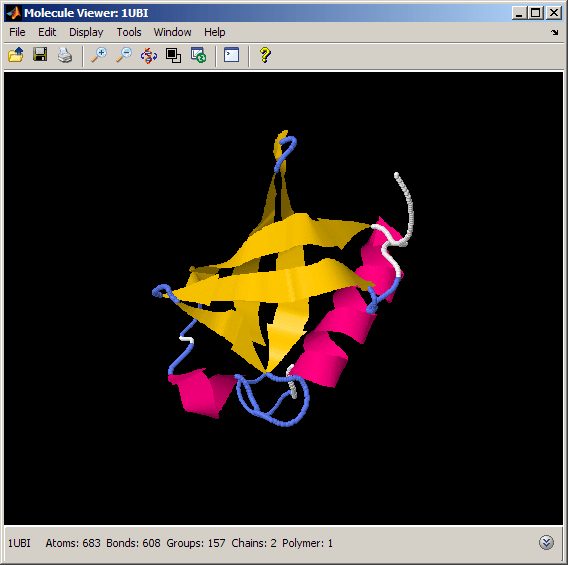
通过旋转和缩放探索分子
泛素折叠由五个反平行的β链,一个α螺旋,一个小的3-10螺旋,和几个旋转和环组成。这种折叠就像一个小桶,桶的一侧由贝塔薄片构成,另一侧由阿尔法螺旋构成。底部部分由3-10螺旋封闭。我们可以通过360度旋转泛素结构和使用“移动”命令放大和缩小来更好地欣赏泛素紧凑的球形折叠。
动画显示通过使结构旋转和放大evalrasmolscript(h1['移动0 180 0 40 0 0 0 0 5;'...%...%旋转y轴180,放大40,时间=5秒'移动0 180 0 -40 0 0 0 0 0 5;']);%旋转y轴180,缩小40,时间=5秒
评估结构中的氨基酸电荷分布
泛素折叠体的致密性和高稳定性与折叠态下疏水亲水氨基酸的空间分布有关。我们可以通过选择带正电荷和负电荷的残基,然后用不同的颜色(分别是红色和蓝色)来观察带电荷氨基酸的分布。我们也可以把水分子变成白色,看看它们与带电残基的关系。
evalrasmolscript(h1[“选择蛋白质;颜色灰色;”...选择积极乐观;红色;spacefill 300;”...“选择消极;蓝色;spacefill 300;”...选择汉宏;颜色白色;spacefill 100;”]);%水原子
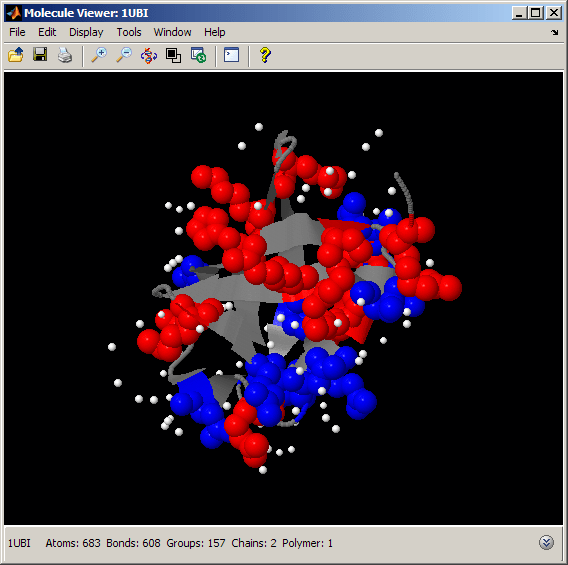
带电氨基酸主要位于接触溶剂的表面,在那里它们与水分子相互作用。特别地,我们注意到泛素桶的电荷分布是不均匀的。事实上,带有α螺旋的那一边似乎比含有β链的那一边更挤满了带电氨基酸。
探索结构的疏水性剖面
我们可以通过观察一些疏水氨基酸(如丙氨酸、异亮氨酸、缬氨酸、亮氨酸和蛋氨酸)的空间分布来进行类似的分析。你也可以使用Rasmol标签“疏水”来选择所有疏水残基。
%颜色疏水性氨基酸绿色evalrasmolscript(h1['全选;空格填充;灰色;'...'选择Ala或Ile或Val或Leu或Met;'...“绿色;线框100;”...'移动90 0 0 0 0 0 1;移动0 -45 0 0 0 0 0 1']);
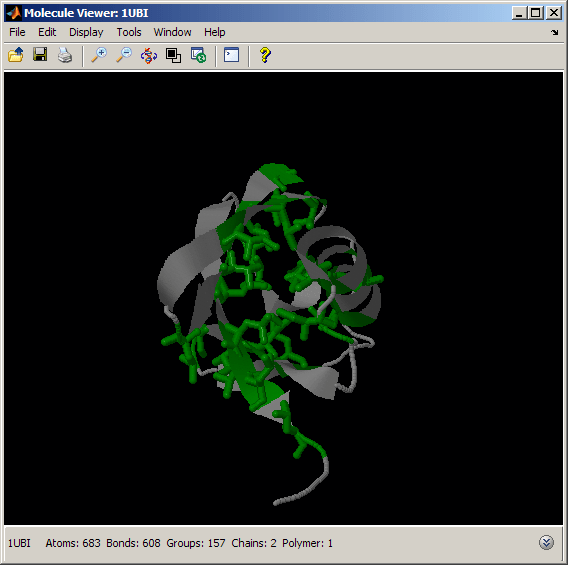
与上面的带电氨基酸不同,疏水氨基酸主要位于桶的内部。这给泛素折叠提供了高稳定性,因为疏水氨基酸被溶剂屏蔽,使蛋白质结构紧凑和紧密。
测量原子的距离
泛素显示一个紧密的折叠,一个α螺旋穿过小桶的一侧。这个α螺旋的长度在泛素样蛋白家族的代表中有一些差异。我们可以通过双击相关原子或使用MATLAB®和Rasmol命令来确定螺旋的实际大小,如下所示。
将显示设置为卡通evalrasmolscript(h1['重置;全选;空格填充关闭;线框关闭;'...'卡通;色彩结构;']);
%确定阿尔法螺旋的边界.initSeqNum initHelixRes = ubi.Helix (1)%α-螺旋起始残基
initHelixRes = 23
.endSeqNum endHelixRes = ubi.Helix (1)%α-螺旋末端残基
endHelixRes = 34
%突出显示螺旋的起始和结束残基evalrasmolscript(h1[“选择”num2str(initHelixRes)”或“...num2str (endHelixRes)“;颜色为红色;线框100;”]);
确定起始和结束残基的原子数inithelixantoms=ubi.Model.Atom([ubi.Model.Atom(:).reseq]==initHelixRes);endhelixantoms=ubi.Model.Atom([ubi.Model.Atom(:).reseq]==endHelixRes);initHelix=min([inithelixantoms.AtomSerNo]);螺旋起始原子endHelix = min ([endHelixAtoms.AtomSerNo]);螺旋末端原子evalrasmolscript(h1[“措施”num2str (initHelix)' 'num2str(端螺旋)';']);

泛素结构中赖氨酸残基的显示和标记
泛素化是指泛素分子附着在靶蛋白上,泛素化过程是由泛素的c -末端4-残基与靶蛋白赖氨酸之间形成的异肽键介导的。如果目标蛋白是另一种泛素,这个过程称为多聚泛素化。由至少四种泛素组成的多聚泛素链被用来标记被蛋白酶体降解的目标蛋白。泛素中的所有七种赖氨酸都可以用于泛素化过程,产生不同的链,以不同的方式改变目标蛋白。我们可以通过选择和标记结构中每个赖氨酸的α碳来观察赖氨酸在泛素折叠上的空间分布。
%突出结构中的赖氨酸残基和c端尾部%参与异肽键的形成evalrasmolscript(h1[限制蛋白质;卡通关;线框关闭;量度......%撤销先前的选择“骨干100;颜色结构;选择赖氨酸;线框100;”......%选择赖氨酸'select Lys and *.ca;spacefill 300;上的标签,“......%标记α碳'选择72-76;线框100;颜色为青色;']);%选择C端子尾部
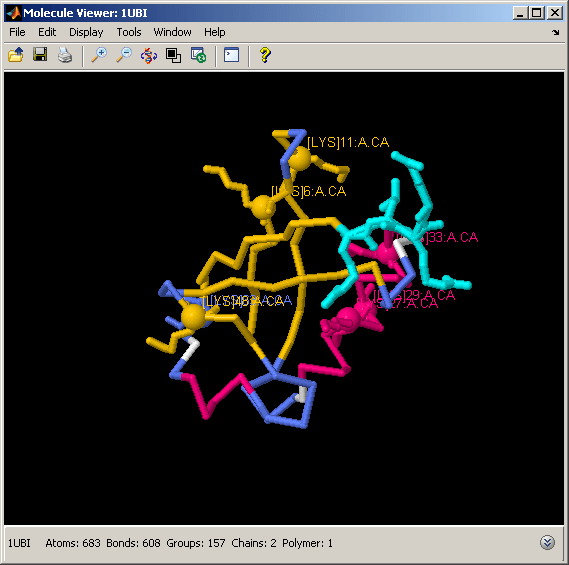
一些研究表明,当分子通过不同的赖氨酸连接在一起时,多聚泛素发挥了不同的作用。例如,Lys(11)-、Lys(29)-和Lys(48)联聚泛素靶向蛋白酶体的蛋白质(即降解)。相反,Lys(6)-和Lys(63)联聚泛素与可逆修饰相关,如蛋白质转运控制。
检测双泛素中的异肽键
由两个基团组成的双泛素链的晶体结构表示在PDB记录1aar中。我们可以观察和标记一个泛素(标记为链A)的c端尾部和另一个泛素(标记为链B)的Lys(48)之间的实际异肽键。
从PDB中检索蛋白质1aar或从MAT-file中加载数据。
aar = getpdb (“1 aar”);
负载(“ubilikedata.mat”,aar的)h2=摩尔查看器(aar);

evalrasmolscript(h2[限制蛋白质;颜色链...“spacefill;线框;”...'卡通打开;选择76:A,48:B;空格填充;'......% isopeptide债券'select 76:A and *.ca; '...选择碳'set labeloffset 40 10;标记异肽键;'...'移动0 360 0 -20 0 0 0 0 0 5;']);%动画
对齐泛素和SUMO序列
有一个令人惊讶的泛素样蛋白家族,其结构与泛素非常相似。其中一种蛋白质是SUMO(小泛素样修饰物),它是一种小蛋白质,参与广泛的翻译后修饰,如转录调节、核胞质转运和蛋白质稳定性。与泛素化类似,SUMO的共价连接和分离通过一系列酶作用发生。尽管泛素和SUMO在结构和操作上有相似之处,但从它们的全局序列比对可以看出,这两种蛋白质的序列相似性非常有限。
从PDB检索蛋白质SUMO或从MAT文件加载数据。
aar = getpdb (“lwm2”);
负载(“ubilikedata.mat”,“相扑”)
将两个化合物的两个主要序列对齐。
[score aln]=nwalign(ubi.Sequence.Sequence,sumo.Sequence.Sequence);显示对齐(aln);

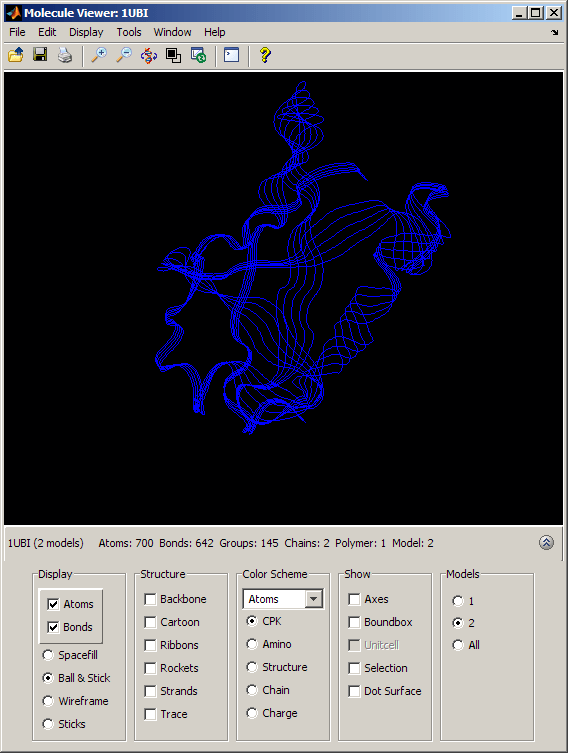
泛素与相扑结构的叠加
为了更好地理解泛素和相扑之间的结构相似性,我们对这两种结构进行了三维叠加。使用pdbsuperpose函数,我们计算并应用线性变换(平移、反射、正交旋转和缩放),使一个结构的原子与另一个结构的原子最一致。
关闭(h1,h2);%关闭以前的molviewer实例pdbsuperpose(无论何时,相扑);
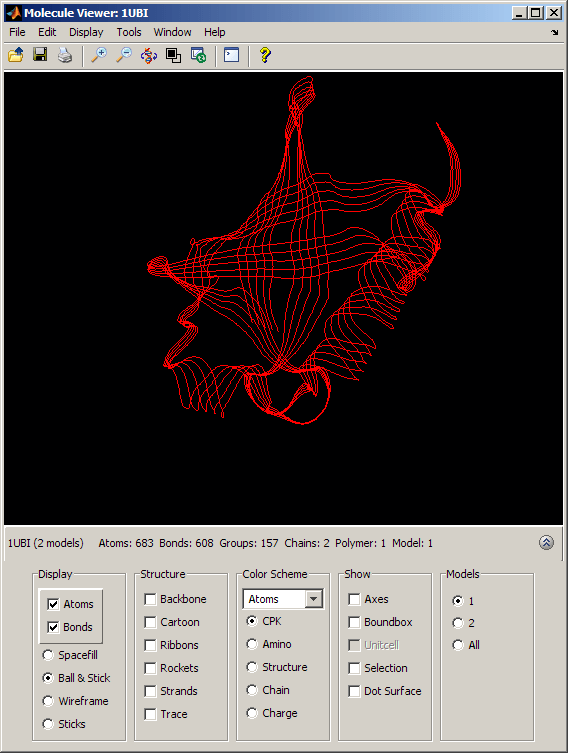
h3=findobj(“标签”,“BioinfoMolviewer”);为molviewer检索句柄evalrasmolscript (h3 ('全选;缩放200;居中选择']);
evalrasmolscript (h3 ("全选,;卡通片...'select model = 1;链;红色,“...%泛素'选择型号=2;绞线打开;颜色为蓝色;']);%相扑
通过选择合适的选项按钮在分子查看窗口的模型部分,我们可以分别查看泛素结构(模型= 1)和SUMO-2结构(模型= 2),或者我们可以看到它们重叠(模型=所有)。当两个模型都被积极展示时,两个褶皱之间的结构相似性是惊人的。


在缺乏显著序列相似性的情况下,结构折叠的保守性可能表明这两种蛋白质发生趋同进化。然而,泛素化和苏木酰化中的一些机制具有类似性,这些类似性不是折叠相关的,并且可能暗示某种更深层的,也许是遥远的关系。更重要的是,泛素和SUMO-2的功能范围如此广泛,这一事实表明,类泛素超蛋白的高稳定性和紧凑性可能是其保守性背后的原因。

