基因表达谱分析
这个例子展示了在基因表达谱中寻找模式的许多方法。
探索数据集
本例使用DeRisi等人发表的酵母基因表达微阵列研究的数据,1997[1]。作者使用DNA微阵列研究了几乎所有基因的暂时性基因表达酿酒酵母在代谢从发酵到呼吸的转变过程中。在二氧移期间的7个时间点测量表达水平。完整的数据集可以从基因表达综合网站下载,https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE28.
的MAT-fileyeastdata.mat包含表达式值(log2的比值CH2DN_MEAN而且CH1DN_MEAN),包括实验中的七个时间步骤、基因的名称以及测量表达水平的时间数组。
负载yeastdata.mat
为了了解您可以使用的数据的大小元素个数(基因)来显示数据集中包含了多少基因。
元素个数(基因)
Ans = 6400
您可以通过索引变量来访问与实验相关的基因名称基因,表示基因名称的细胞数组。例如,第15个元素基因YAL054C。这表示变量的第15行yeastvalues包含YAL054C的表达水平。
基因{15}
ans = 'YAL054C'
可以使用一个简单的图来显示这个ORF的表达式概要。
Plot (times, yeastvalues(15,:)) xlabel(的时间(小时));ylabel (“Log2相对表达式水平”);

您还可以绘制实际的表达式比率,而不是log2转换的值。
Plot (times, 2.^yeastvalues(15,:)) xlabel(的时间(小时));ylabel (“相对表达水平”);

与该ORF相关的基因ACS1,似乎在二氧移期间被强烈上调。你可以在同一幅图上绘制多条线,将该基因的表达与其他基因的表达进行比较。
持有在Plot (times, 2.^yeastvalues(16:26,:)') xlabel(的时间(小时));ylabel (“相对表达水平”);标题('Profile Expression Levels');

筛选基因
通常,基因表达数据集包含与实验中没有显示出任何有趣变化的基因对应的信息。为了更容易找到感兴趣的基因,可以将数据集的大小缩小到只包含最重要基因的某个子集。
如果你浏览基因列表,你会看到几个标记为“空”.这些是数组上的空点,虽然它们可能有与之关联的数据,但对于本例来说,您可以将这些点视为噪声。这些点可以用比较字符串函数,并使用索引命令从数据集中删除。
空点= strcmp(“空”,基因);yeastvalues(emptySpots,:) = [];基因(emptySpots) = [];元素个数(基因)
Ans = 6314
在数据集中还可以看到几个地方的表达式级别被标记为南.这表明在特定的时间步骤中没有收集到该点的数据。处理这些缺失值的一种方法是使用特定基因随时间变化的数据的平均值或中位数来估算它们。这个例子使用了一种不那么严格的方法,即简单地丢弃没有测量一个或多个表达水平的任何基因的数据。这个函数isnan用于识别缺失数据的基因,索引命令用于删除缺失数据的基因。
nanIndices = any(isnan(yeastvalues),2);yeastvalues(nanIndices,:) = [];基因(nanIndices) = [];元素个数(基因)
Ans = 6276
如果您要绘制所有剩余概要文件的表达式概要文件,您将看到大多数概要文件是平坦的,与其他概要文件没有显著不同。这一平坦的数据显然是有用的,因为它表明与这些剖面相关的基因不受二适性移位的显著影响;然而,在这个例子中,你感兴趣的是伴随二氧移的表达有很大变化的基因。您可以使用生物信息学工具箱™中的过滤功能来删除具有各种类型的配置文件的基因,这些配置文件不能提供有关受代谢变化影响的基因的有用信息。
您可以使用genevarfilter函数过滤出随时间变化的小变异基因。该函数返回一个与变量大小相同的逻辑数组(即掩码)基因对应的行yeastvalues方差大于第10百分位数,对应于阈值以下的零。您可以使用掩码对值进行索引并删除过滤的基因。
掩码= genevarfilter(yeastvalues);Yeastvalues = Yeastvalues (mask,:);基因=基因(面具);元素个数(基因)
Ans = 5648
这个函数genelowvalfilter去除绝对表达值非常低的基因。注意,这些过滤器函数还可以自动计算过滤后的数据和名称,因此不需要使用掩码索引原始数据。
[mask,酵母值,基因]= genelowvalfilter(酵母值,基因,“absval”log2 (3));元素个数(基因)
Ans = 822
最后,您可以使用该函数geneentropyfilter去除谱图中熵值较低的基因,例如数据中第15百分位的熵值。
[mask,酵母值,基因]=基因熵过滤器(酵母值,基因,“prctile”15);元素个数(基因)
Ans = 614
聚类分析
现在您已经有了一个可管理的基因列表,您可以使用Statistics and Machine Learning Toolbox™中的一些不同的聚类技术来查找配置文件之间的关系。对于层次聚类,函数pdist计算轮廓和之间的成对距离链接创建分级集群树。
corrDist = pdist(酵母值,“相关系数”);clusterTree = linkage(corrDist,“平均”);
的集群函数根据截止距离或最大簇数计算簇。在这种情况下,maxclust选项用于识别16个不同的集群。
cluster = cluster(clusterTree,“maxclust”16);
这些簇中的基因图谱可以用一个简单的循环和图次要情节命令。
数字为C = 1:16 subplot(4,4, C);Plot (times,yeastvalues((clusters == c),:)');轴紧结束sgtitle (“档案的层次聚类”);
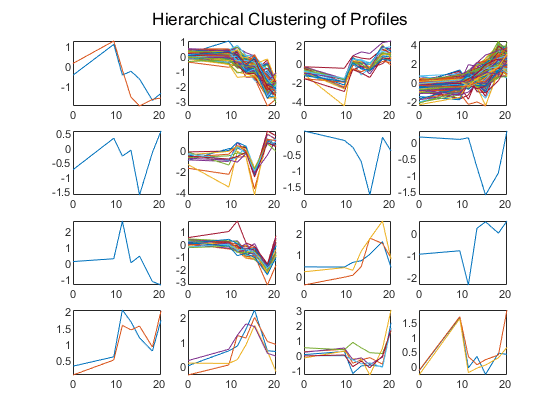
统计和机器学习工具箱也有K-means聚类功能。同样,找到了16个聚类,但由于算法不同,这些聚类不一定与层次聚类找到的聚类相同。
初始化随机数生成器的状态,以确保这些命令生成的数字与本例HTML版本中的数字匹配。
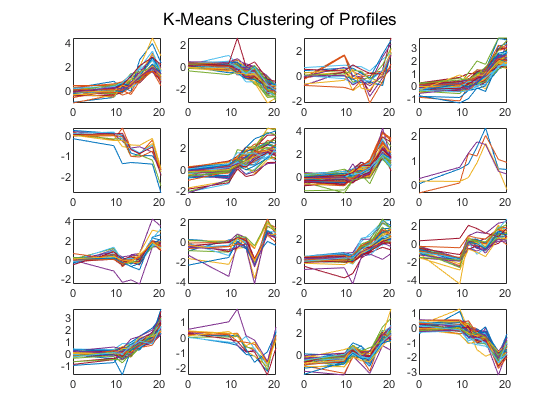
rng (“默认”);[cidx, ctrs] = kmeans(yeastvalues,16,“距离”,“相关系数”,“代表”5,“disp”,“最后一次”);数字为C = 1:16 subplot(4,4, C);Plot (times,yeastvalues((cidx == c),:)');轴紧结束sgtitle (“k -均值剖面聚类”);
重复1,21次迭代,总距离之和= 23.4699。复制2,22次迭代,总距离之和= 23.5615。重复3,10次迭代,总距离之和= 24.823。重复4,28次迭代,总距离之和= 23.4501。重复5次,19次迭代,总距离之和= 23.5109。最佳总距离之和= 23.4501
你可以只画质心,而不是画所有的剖面。
数字为C = 1:16 subplot(4,4, C);情节(次,点击率数据(c:) ');轴紧轴从结束sgtitle (“k -均值剖面聚类”);

您可以使用clustergram函数从层次聚类的输出创建表达级别的热图和树状图。
cgObj = clustergram(yeastvalues(:,2:end),“RowLabels”的基因,“ColumnLabels”,乘以(2:结束));

主成分分析
主成分分析(PCA)是一种有用的技术,可用于降低大型数据集(如微阵列数据集)的维数。PCA也可以用于在有噪声的数据中寻找信号。这个函数mapcaplot计算数据集的主成分,并创建结果的散点图。您可以交互式地从其中一个图中选择数据点,这些点在另一个图中自动突出显示。这让您可以同时可视化多个维度。
H = mapcaplot(酵母值,基因);

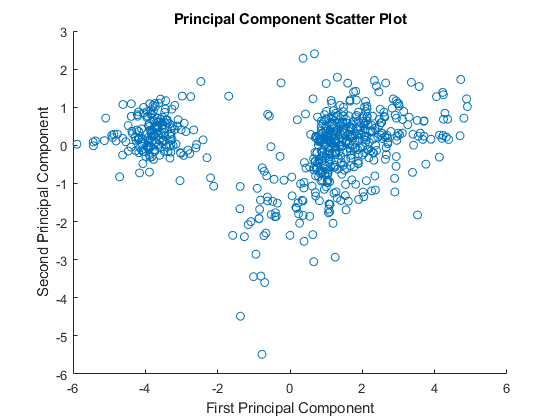
请注意,前两个主成分的分数的散点图显示有两个不同的区域。这并不意外,因为过滤过程删除了许多低方差或低信息的基因。这些基因会出现在散点图的中间。
如果你想看主成分的值主成分分析统计和机器学习工具箱中的函数用于计算数据集的主成分。
[pc, zscores, pcvars] = pca(yeastvalues);
第一个输出,个人电脑,是主成分的矩阵yeastvalues数据。矩阵的第一列是第一主成分,第二列是第二主成分,以此类推。第二个输出,zscores,由主成分分数组成,即主成分空间中酵母值的表示。第三个输出,pcvars,包含主成分方差,它给出了一个度量数据的方差有多少是由每个主成分所占。
很明显,第一个主成分占了模型中方差的大部分。您可以计算每个组件所占方差的确切百分比,如下所示。
pcvars./sum(pcvars) * 100
Ans = 79.8316 9.5858 4.0781 2.6486 2.1723 0.9747 0.7089
这意味着几乎90%的方差是由前两个主成分解释的。您可以使用cumsum命令查看方差的累积和。
Cumsum (pcvars./sum(pcvars) * 100)
Ans = 79.8316 89.4174 93.4955 96.1441 98.3164 99.2911 100.0000
如果希望对主成分的绘图有更多的控制,可以使用散射函数。
图散射(zscores (: 1), zscores (:, 2));包含(“第一主成分”);ylabel (“第二主成分”);标题(“主成分散点图”);
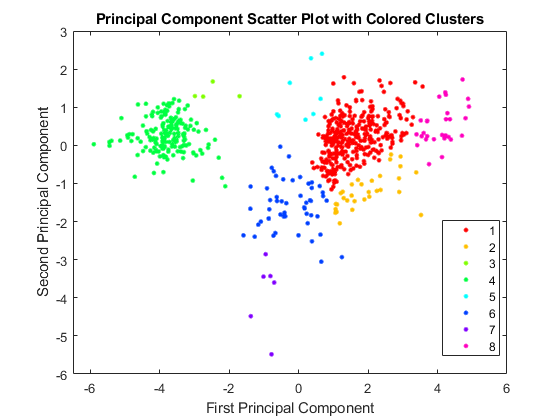
创建散点图的另一种方法是使用函数gscatter来自统计和机器学习工具箱。gscatter创建分组散点图,其中每个组中的点具有不同的颜色或标记。你可以使用clusterdata,或任何其他聚类函数,以对点进行分组。
图pcclusters = clusterdata(zscores(:,1:2),“maxclust”8“链接”,“影音”);gscatter (zscores (: 1) zscores (:, 2), pcclusters, hsv(8)包含(“第一主成分”);ylabel (“第二主成分”);标题(彩色簇主成分散点图);
自组织映射
如果您有深度学习工具箱™,您可以使用自组织映射(SOM)来聚类数据。
检查是否安装了“深度学习工具箱”。%如果~((存在“selforgmap”),“文件”) disp (“这个例子的自组织地图部分需要深度学习工具箱。”)返回结束
的selforgmap函数创建一个新的SOM网络对象。本例将使用前两个主要组件生成SOM。
P = zscores(:,1:2)';Net = selforgmap([4 4]);
使用默认参数训练网络。
net = train(net,P);
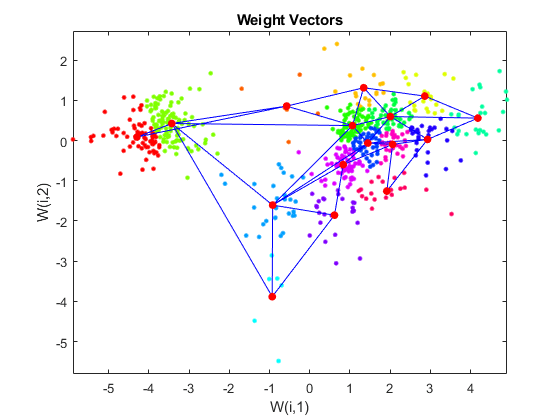
使用plotsom在数据的散点图上显示网络。请注意,SOM算法使用随机起点,因此每次运行的结果都会有所不同。
图绘制(P(1:)、P (2:)“.g”,“markersize”, 20)在net.layers plotsom (net.iw {1}, {1} .distances)从

您可以使用SOM为数据集中的每个点找到最近的节点来分配集群。
距离= dist(P',net.IW{1}');[d,cndx] = min(距离,[],2);CNDX包含群集索引图gscatter (P(1:)、P (2:), cndx, hsv(元素个数(独特(cndx))));传说从;持有在net.layers plotsom (net.iw {1}, {1} .distances);持有从
关闭所有数字。
关闭(“所有”);删除(cgObj);删除(h);
参考文献
[1] DeRisi, J.L, Iyer, V.R.和Brown, P.O,“在基因组尺度上探索基因表达的代谢和遗传控制”,科学,278(5338):680- 67,1997。
